« Quel est l’animal le plus meurtrier au monde ? » On entend souvent cette question, et une fois passés les requins blancs, serpents et autres méduse-boîtes vient toujours un petit malin pour répondre « Le moustique ! ». Bon ok il n’a pas tort le petit malin. Mais pour être plus précis le moustique n’est qu’un taxi pour le vrai tueur numéro 1 sur cette planète. On l’appelle la Malaria, le « mauvais air » mais la maladie est plus connue sous le nom de Paludisme et cause 500 000 morts par an dans le monde. Le parasite en cause est un protozoaire appelé Plasmodium qui regroupe plusieurs espèces (P. falciparum, P. malariae, P. vivax, etc). Parler de ce tueur en série c’est l’occasion de parler un peu d’immunité, d’évolution, mais avant tout c’est l’occasion de parler des parasites !
Parasitisme
Avant d’aller plus loin une petite définition s’impose : qu’est-ce qu’un parasite ? Les dictionnaires vous diront que c’est un organisme qui vit aux dépens d’un autre organisme appelé hôte. Un peu comme ce colocataire qui profite du toit, du micro-onde et de la connexion wifi mais qui ne paie jamais le loyer. On l’oppose souvent à la symbiose, où les deux êtres vivants ont besoin l’un de l’autre. En effet le parasite va utiliser à son profit les ressources de son hôte, sans lui être indispensable, voire lui être néfaste... Plus de fromage rapé dans le frigo ? C’est le parasite. Il est important de préciser que ce n’est qu’un mode de vie parmi d’autre. Un moyen pour un organisme de trouver l’énergie suffisante pour se reproduire. Nous, humains, avons trouvé une autre méthode commune à de nombreux autres animaux sur cette planète : la prédation. Le prédateur va chasser et tuer sa proie. La relation entre le prédateur et la proie est courte et sanglante, l’un imposant une pression de sélection sur l’autre. Les proies plus adaptées à échapper à leur prédateur vont survivre, se reproduire, et transmettre ce caractère à leur descendance perpétuant leurs gènes. Tandis que l'information génétique des proies tuées est perdu.

Dans le cas du parasitisme si le bilan est le même, un transfert d'énergie entre deux organismes, la relation différente. Notre parasite vit au contact de son hôte, parfois pendant une courte période de sa vie, mais parfois pendant des années comme le ver solitaire ou Ténia. Les deux organismes se côtoient de manière très étroite et le système immunitaire de l’hôte joue un peu le rôle du prédateur qui cherche à éliminer le parasite. Et comme la gazelle qui a évolué pour fuir plus rapidement les lions, les parasites évoluent également pour échapper à notre système immunitaire… Et pour cela ils redoublent d’ingéniosité !
Le globule rouge : une planque idéale
Dans un article précédent de ce blog, vous avez pu apprendre que nos cellules ont un mécanisme efficace pour se protéger d’un organisme qui voudrait vivre à l’intérieur, comme un virus, il s’agit des molécules de CMH. Or, toutes les cellules n’en possèdent pas ! Par exemple les globules rouges qui transportent l’oxygène dans le sang via l’hémoglobine sont totalement dépourvues de ce système de défense. Ce n’est pas un problème contre les virus car les globules rouges sont des cellules sans noyau, relativement simples. Or le virus, très simple également, aime les cellules qui lui fourniront tous les outils pour sa réplication. Bref, pour envahir le globule rouge il faut venir avec son propre matériel et ça n’intéresse pas le virus partisan du moindre effort. Pourtant c’est la cachette qu’a choisi le paludisme ! Il n’a pas choisi la facilité, mais une fois à l’intérieur il passe totalement incognito... ou presque.
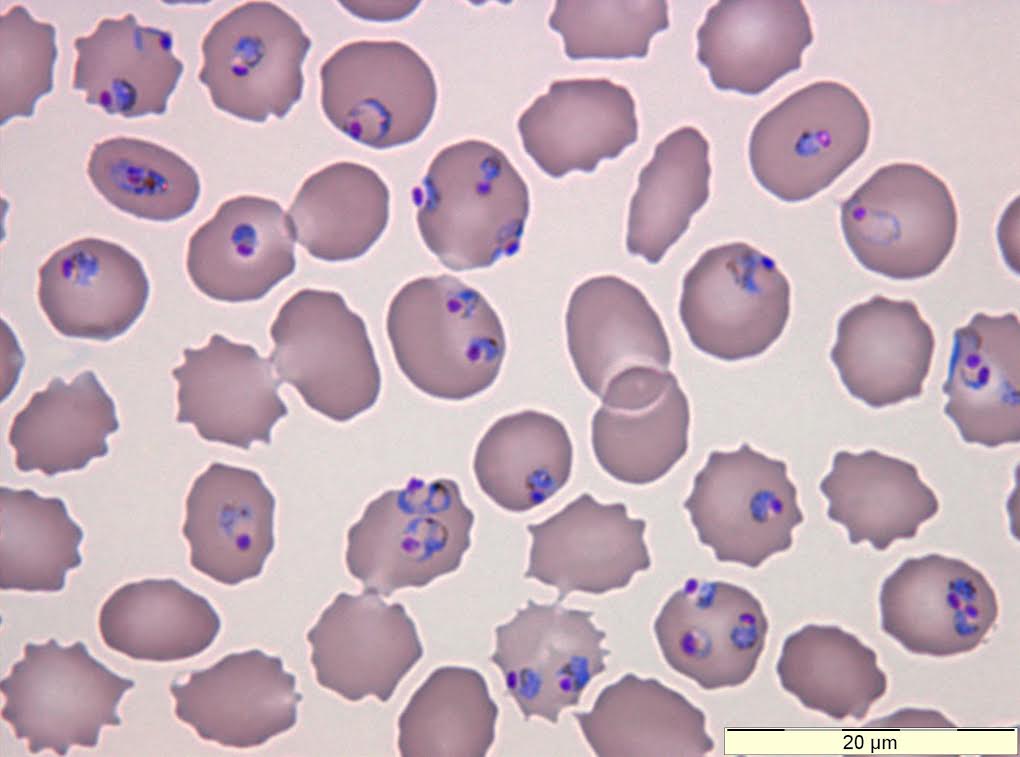
Le globule rouge est fortement modifié par son squatteur et de nombreuses protéines du parasite sont exprimées à la surface de la cellule. Parmi celles-ci on peut citer la Plasmodium falciparum erythrocyte membrane protein 1, ou plus court mais tout aussi galère à prononcer : PfEMP1. Cette protéine permet entre autres au globule rouge parasité d’adhérer à la surface de nos vaisseaux sanguins. Une habile stratégie pour échapper au piège de la rate, l’organe qui filtre notre sang. Mais le paludisme aurait-il fait l’erreur de trahir sa présence ? Voilà des protéines à la surface du globule rouge qui ne sont pas humaines ! Que fait l’immunité ?!... Sauf que Plasmodium est plus malin que ça. PfEMP1 est codé par des gènes particuliers appelés var gene. Ces var gene sont au nombre d’une soixantaine, un seul est exprimé à la fois, ce qui veut dire qu’une seule forme de PfEMP1 est exprimée à la fois. Le temps que des anticorps soient produits contre ces protéines, Plasmodium produit une nouvelle fournée de PfEMP1, juste assez différentes pour ne pas être reconnues par notre système immunitaire. Les nouvelles PfEMP1 remplacent les anciennes et le parasite continue de se balader en costume de globule rouge.

C’est la force du paludisme, comme de beaucoup d’autres parasites, d’être variable pour lutter contre la pression que leur impose notre immunité. C’est cette même variabilité antigénique qui rend si difficile l’élaboration d’un vaccin contre le fléau du paludisme ! Mais leur variabilité s’étend encore au-delà… Puisque les parasites doivent souvent s’adapter à plusieurs hôtes comme c’est le cas ici avec le moustique et l’être humain. Et dans chaque hôte, ils sont capables de se transformer pour s’adapter à différentes parties de l’organisme.
Le cycle du paludisme
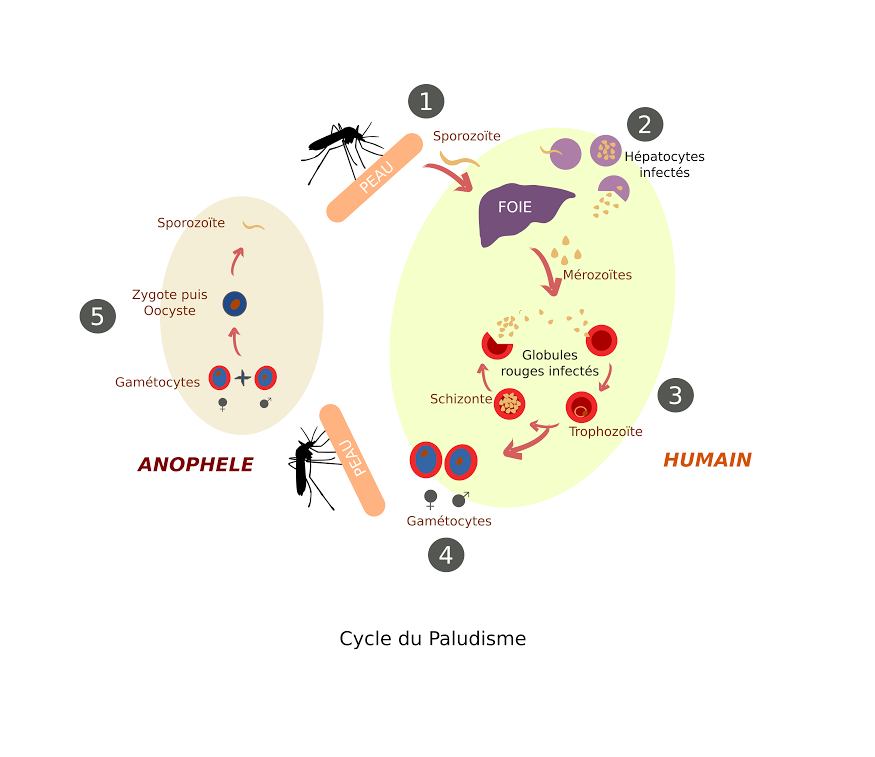
Puisqu’il faut prendre un point de départ dans un cycle, prenons la piqure du moustique. La piqure du moustique (Anophèle) va injecter dans la peau de l’homme le Plasmodium sous une forme mobile appelée sporozoïte (1). Le sporozoïte va rapidement rejoindre le foie dont il va parasiter des cellules pendant quelques jours (2). Ce n’est qu’après cette première multiplication dans le foie que le paludisme va rejoindre le sang sous forme de mérozoites et infecter nos globules rouges. A chacune de ces étapes, notre immunité monte une garde vigilante et toutes les stratégies du parasite pour y échapper ne sont pas encore élucidées. Une fois bien installé dans le globule rouge, le parasite va croitre et se multiplier à l’intérieur. Cette multiplication a une durée bien précise, de 2 à 3 jours selon les espèces et se termine par l’explosion du globule rouge… Ou plus précisément de tous les globules rouges infectés, simultanément. Les globules rouges déversent alors une grande quantité de mérozoites qui vont infecter à nouveau d’autres globules rouges (3). C’est cette abondance de mérozoites dans le sang au moment de l’explosion des globules rouges qui cause la fièvre du paludisme. Certains globules rouges parasités vont se transformer en gamétocytes (4), mâles ou femelles. Ce sont les équivalents de nos spermatozoïdes et ovules. Si un moustique pique l’être humain parasité il va se nourrir de son sang, et au passage des gamétocytes. Les gamétocytes se fécondent dans le moustique, pour donner un zygote puis un oocyste. Ce dernier libérera une nouvelle génération de sporozoïtes prête à être injectée à une autre victime humaine (5)… Et le cycle est bouclé !
La course à l'adaptation
Le paludisme n'est pas le seul à s'adapater à son hôte. L'hôte également cherche à se protéger du parasite. Ou plutôt dans le cas des parasites mortels comme le paludisme, l'hôte résistant au parasite peut être sélectionné.
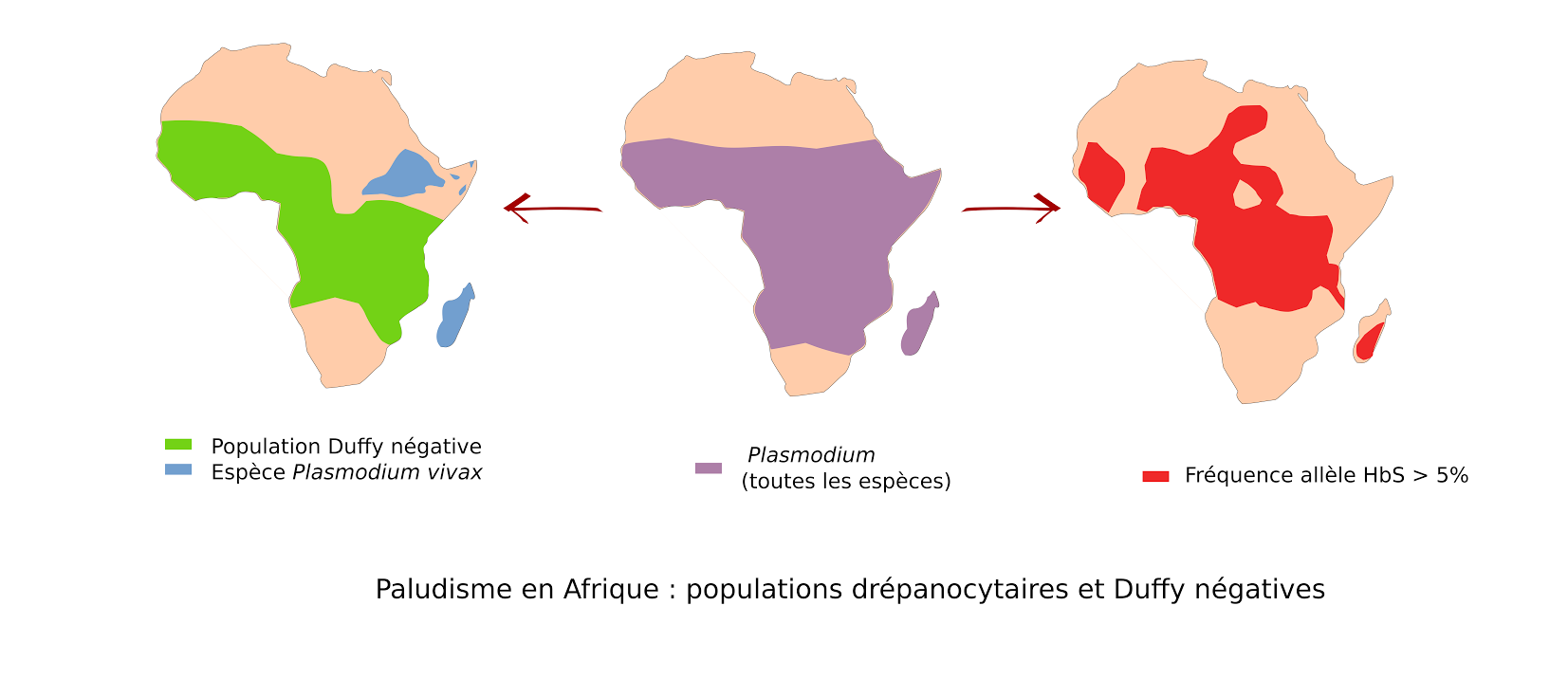
Un des exemples les plus frappants concerne la drépanocytose. Cette maladie génétique touche la molécule d'hémoglobine, contenue dans le globule rouge. L'hémoglobine mutée (HbS) transporte moins efficacement l'oxygène et entraîne une forme plus rigide "en faucille" du globule rouge. Etre porteur d'un seul allèle muté sur les deux permet de vivre normalement et il a été montré qu'être porteur de la drépanocytose protégeait de l'infection par le paludisme!. On observe effectivement que cette maladie génétique et le paludisme sont présents dans les mêmes régions d'Afrique (cartes de gauche et du milieu). Les humains porteurs de la maladie génétique ont donc pu être sélectionnés, car moins sujets à des formes mortelles de paludisme.
Un autre exemple concerne les groupes sanguins. Nos groupes sanguins sont des antigènes (faits de protéines, glucides et lipides) à la surface de nos globules rouges. Les groupes A, B, O sont les plus connus, mais il en existe d'autres et un des groupes sanguins mineurs, le groupe Duffy, est nécessaire à l'entrée de l'espèce Plasmodium vivax dans le globule rouge... On observe que cette espèce est absente de toute l'Afrique de l'ouest où la grande majorité de la population est Duffy Négative! Malheureusement, Plasmodium vivax a été remplacée dans ces régions par d'autres espèces de Plasmodium qui n'ont pas besoin de Duffy pour rentrer dans nos globules rouges (cartes du milieu et de droite).
A quoi servent ces groupes sanguins d'ailleurs ?... Voilà une question qui sera traitée dans un prochain article sur ce blog !
Conclusion
Les parasites sont des organismes complexes qui ont su s’adapter à de nombreux organismes. Les stratégies d’échappement sont multiples. Nous avons parlé de la variabilité antigénique, mais d’autres parasites excellent dans l’art du camouflage ou du leurre. Ces systèmes de survie ne doivent pas être confondues par une intention ou une intelligence du parasite. Il s’agit plutôt d’un équilibre qui a été obtenu sur du long terme. Un parasite qui côtoie un hôte depuis suffisamment de générations (on parle ici de millions d’année de co-évolution entre l’hôte et son parasite) peut devenir totalement anodin pour l’organisme qu’il occupe. On peut ainsi imaginer que certaines symbioses ne sont que des parasitismes qui se sont adaptés à la perfection. Le couple paludisme-homme a donc encore du chemin à faire…
Moralité : si votre coloc, pour échapper à votre colère immune décide de vous faire des pizzas pour détourner votre attention … vous pourriez bien finir par l’accueillir comme une machine à pizza tout à fait légitime qui a sa place dans votre appartement ! (toute ressemblance avec la symbiose entre les mitochondries et nos cellules est totalement fortuite)
Références
- Diagnostic microscopique du paludisme
- Kraemer, S. M. & Smith, J. D. A family affair: var genes, PfEMP1 binding, and malaria disease. Curr. Opin. Microbiol. 9, 374–380 (2006).
- OMS
- Ferreira, A. et al. Sickle hemoglobin confers tolerance to Plasmodium infection. Cell 145, 398–409 (2011).
- Langhi, D. M. & Bordin, J. O. Duffy blood group and malaria. Hematol. Amst. Neth. 11, 389–398 (2006).
- Parasitoses et mycoses des régions tempérées et tropicales, Auteur : Association Française des Enseignants de Parasitologie médicales ANOFEL, Editeur : ELSEVIER / MASSON paru le : 09/2014 (3ème édition)
Ce site est versionné sur GitHub. Vous pouvez corriger des erreurs en vous rendant à cette adresse
Go Top