Si vous êtes passé à côté de la news de la semaine, sachez qu'une équipe américaine a réussi à corriger une mutation génétique lors d'une fécondation in vitro à l'aide du couteau suisse moléculaire CRISPR-Cas9. Une grande étape a été franchie en thérapie génique avec tous les problèmes éthiques qui en découlent comme l'eugénisme ou le transhumanisme. Je me dois de vous faire un résumé rapide de cet article "Correction of a pathogenic gene mutation in human embryos" disponible ici.
Correction d'une maladie autosomique dominante
L'équipe a choisi de corriger une mutation sur le gène MYBPC3 responsable d'une cardiomyopathie hypertrophique héréditaire. C'est la maladie du sportif qui fait une mort subite en plein match.
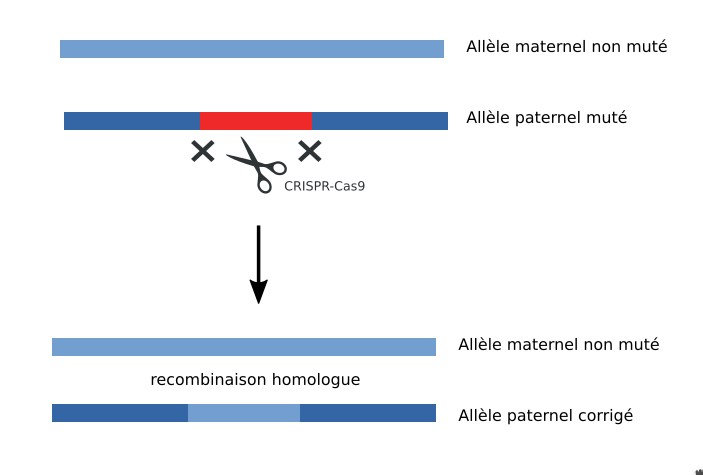
C'est une maladie autosomique dominante. C'est-à-dire qu'un seul allèle muté suffit pour provoquer la maladie. C'est important pour la suite, car l'édition du gène a besoin de la présence d'un allèle sain.
La mutation cible est une délétion de 4 nucléotides dans l'exon 16 du gène.
Édition avec CRISPR-cas9
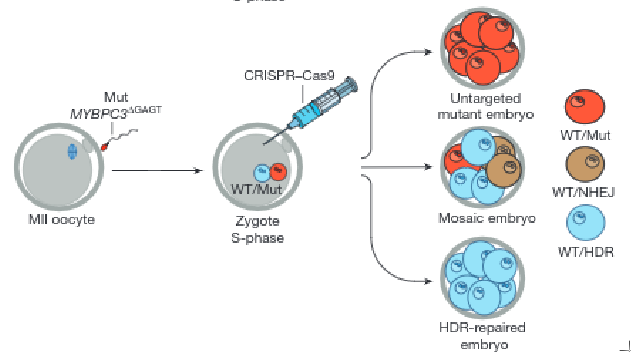
L'édition du gène a été réalisée après fécondation in vitro entre le spermatozoïde d'un patient porteur de la mutation et un ovocyte sain. Le complexe CRISPR-Cas9 a été injecté dans l'oeuf 18h après fécondation par micro-injection (vidéo). CRISPR-Cas9 fait une coupure double brin pour retirer la région d'ADN contenant la mutation. Puis une polymérase entre en action et corrige ce trou béant en utilisant l'allèle homologue non muté comme modèle. C'est ce qu'on appelle une réparation par recombinaison homologue ou HDR (Homology Directed Repear). Pour cette raison, seules les mutations hétérozygotes peuvent être corrigées avec ce protocole. Un autre mécanisme de réparation non conservatrice peut avoir lieu, la Jonction d'extrémités non homologues ou NHEJ (Non-Homologous End-Joining). Cette dernière ne corrige rien, et l'on cherche à l'eviter autant que possible.
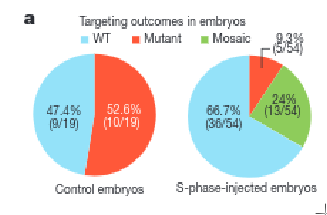
L'expérience a été répétée plusieurs fois. Au total dans l'étude il y a eu 19 embryons témoins non injectés et 54 embryons injectés. L'ensemble des embryons ont ensuite été séquencés au stade 4-8 cellules pour voir si l'édition a réussi.
bien, mais pas encore au point !
Chez les témoins, comme on s'y attend, la moitié des embryons ont été fécondés par un spermatozoïde muté (hétérozygote: 10/19) ou par un spermatozoïde non muté (homozygote: 9/19). Je rappelle que le père est hétérozygote pour la mutation et donc que la moitié de ses spermatozoïdes porte la mutation. En revanche, dans les embryons injectés 66.7% (36/54) sont homozygotes sains et seulement 9.3% (13/54) sont hétérozygotes mutés. Les 24% (5/54) restant, corresponde à des embryons en mosaiques. Ce sont des embryons où certaines cellules ont été corrigées et d'autre non. En conclusion, ça marche, mais la technique n'est pas encore au point, car il reste pas mal de mosaïssisme. Pour y remédier, l'idée proposée est de faire l'injection CRISPR-cas9 au même moment que l'injection du spermatozoïde. Il y a également le risque des mutations induit par CRISPR-Cas9. Les fameuses mutations off-target. Aucune n'a été détectée dans cette étude.
Et l'éthique dans tout ça ?
Pour l'heure, l'ASHG a donné son autorisation sur l'édition des embryons tant que les recherches ne conduisent pas à une grossesse et qu'il y a un rationnel scientifique et éthique derrière.
Mais un pas a tout de même été franchi, et je pense que rapidement, l'édition des génomes deviendra aussi courante que le diagnostic préimplantatoire.
Avec l'apparition croissante des start-up en génomique, comme 23andMe ou Helix qui s'affranchissent de la barrière médicale, les enjeux éthiques vont vite prendre de l'ampleur. Et les bébés conçus à la carte sur internet seront peut-être monnaie courante.
D'autre part, l'éradication des maladies génétiques peut paraitre merveilleuse. Mais à l'échelle des populations cela implique la diminution de la diversité génétique et donc une diminution de notre capacité d'aptation dans l'évolution biologique.
Bienvenue à GATTACCA n'a jamais été aussi proche.

Ce site est versionné sur GitHub. Vous pouvez corriger des erreurs en vous rendant à cette adresse
Go Top